OPR細(xì)胞篩選模型
發(fā)布時(shí)間:2024/09/30分類:技術(shù)文章來源:科佰生物
背景
疼痛大致可分為兩大類:生理性疼痛和病理性疼痛。生理(也稱為急性或傷害性)疼痛是一個(gè)重要的早期預(yù)警信號(hào),通常引起反射性退縮,從而促進(jìn)生存保護(hù)免受(進(jìn)一步)傷害。這種類型的疼痛不是治療干預(yù)的目標(biāo)。病理性(如神經(jīng)性、慢性)疼痛是生物體對(duì)組織損傷(不良)適應(yīng)的一種表達(dá)。
阿片類藥物(Opioids)是目前應(yīng)用最廣泛、最有效的治療疼痛的鎮(zhèn)痛藥物。阿片類藥物用于治療疼痛已有數(shù)千年的歷史。阿片系統(tǒng)在疼痛行為和抗傷害感受調(diào)節(jié)中起關(guān)鍵作用。阿片類多肽和它們的受體在整個(gè)痛覺神經(jīng)回路中除中樞神經(jīng)系統(tǒng)的關(guān)鍵區(qū)域外表達(dá),還包括與獎(jiǎng)勵(lì)和情緒有關(guān)的區(qū)域大腦結(jié)構(gòu)。迄今為止,在細(xì)胞、分子和藥理學(xué)水平被研究的四種不同的阿片類受體為:OPRM1 (Mu(μ)),OPRD1(Delta(δ)),OPRK1 (Kappa(κ)),OPRL1 (ORL1)。
Opioid Receptor (OPR) 及其配體
阿片受體(OPR) 屬于A類g蛋白偶聯(lián)受體,可被嗎啡等生物堿類阿片和內(nèi)源性配體如內(nèi)啡肽、腦啡肽等激活。OPR及其配體可見下表。
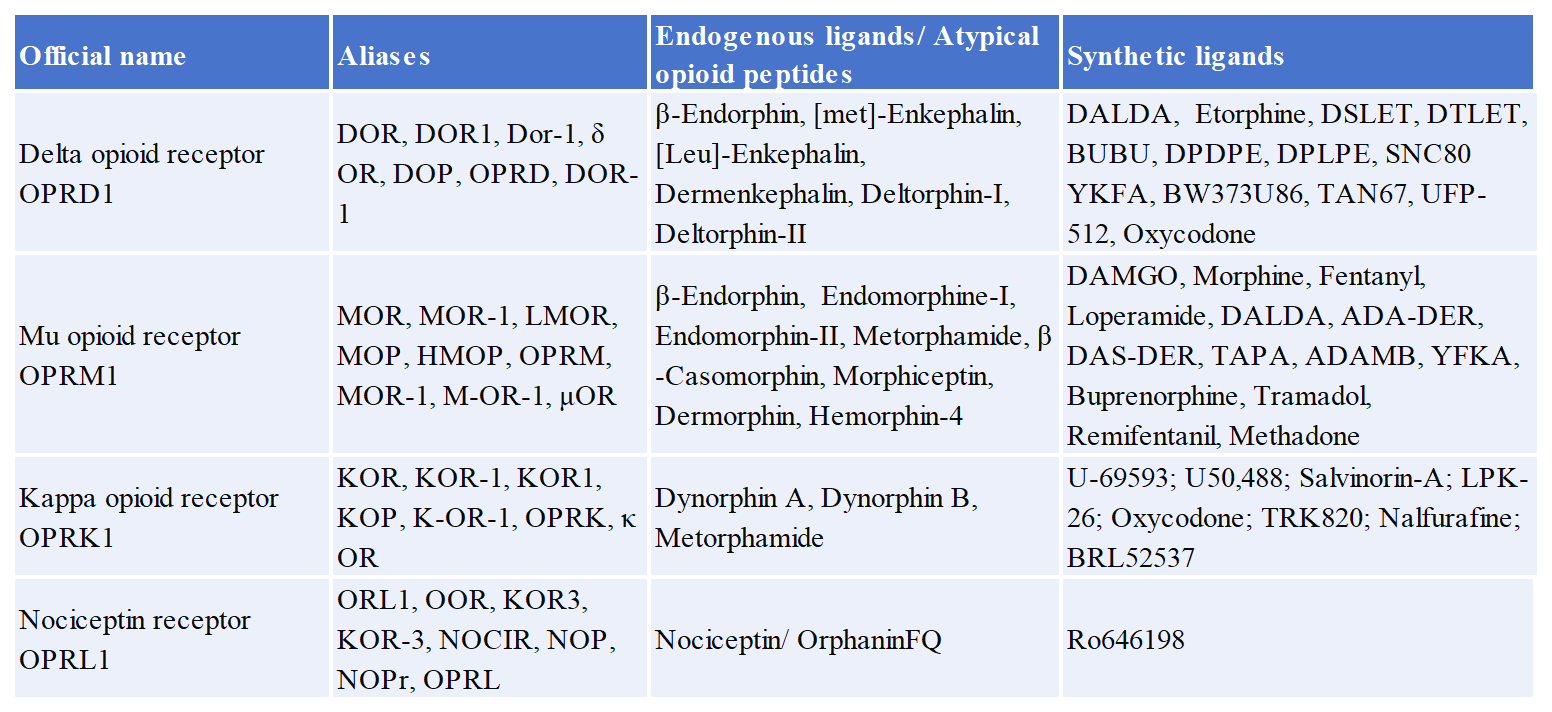
阿片類受體主要由中樞和外周神經(jīng)元以及神經(jīng)內(nèi)分泌(垂體,腎上腺),免疫和外胚層細(xì)胞等表達(dá)。阿片受體廣泛分布于人體,通過經(jīng)典阿片受體亞型(mu, delta和kappa以及較少表征的亞型,阿片受體樣(ORL1))參與眾多生理過程。阿片受體被激動(dòng)劑激活后,通過肌腸神經(jīng)元抑制乙酰膽堿(ACh),部分抑制抑制性運(yùn)動(dòng)神經(jīng)元釋放嘌呤和一氧化氮,導(dǎo)致腸道推進(jìn)性運(yùn)動(dòng)減慢。此外,它們的刺激通過抑制分泌運(yùn)動(dòng)粘膜下神經(jīng)元減少氯離子的分泌,導(dǎo)致被動(dòng)水運(yùn)動(dòng)進(jìn)入管腔減少,從而導(dǎo)致大便硬化,導(dǎo)致便秘增加。同時(shí),刺激位于下丘腦的阿片受體會(huì)抑制GnRH的釋放,從而導(dǎo)致雌激素和睪酮分泌減少。因此,這些受體的慢性激活導(dǎo)致骨質(zhì)疏松和性功能障礙,表現(xiàn)為性欲下降、不孕癥和骨質(zhì)脆性增加。
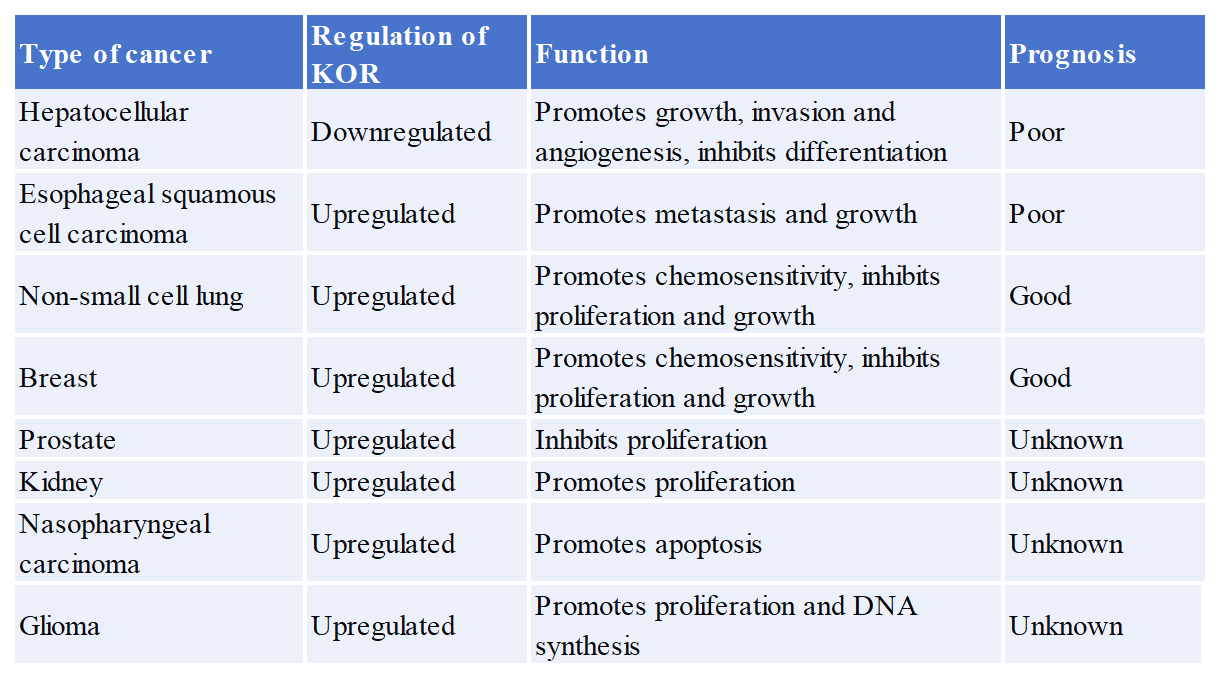
阿片類藥物是最有效的鎮(zhèn)痛藥,已廣泛用作治療疼痛和相關(guān)疾病的治療藥物。除了疼痛,阿片類藥物還經(jīng)常用于治療許多其他疾病包括腹瀉、咳嗽、術(shù)后疼痛和癌癥。有報(bào)道指出KOR可能與幾種癌癥的預(yù)后有關(guān),如下圖所示:
Opioid Receptor (OPR) 經(jīng)典信號(hào)通路
阿片受體在疼痛調(diào)節(jié)下行通路中表達(dá),其中包括髓質(zhì)藍(lán)斑和導(dǎo)水管周圍灰色區(qū)。它們也在大腦邊緣,中腦和皮質(zhì)結(jié)構(gòu)。
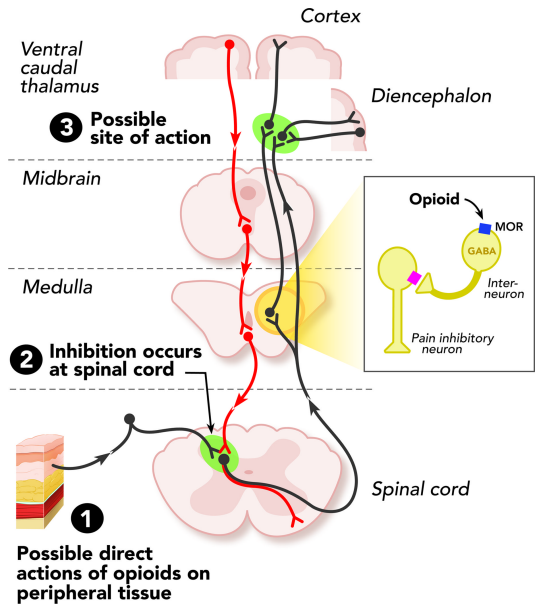
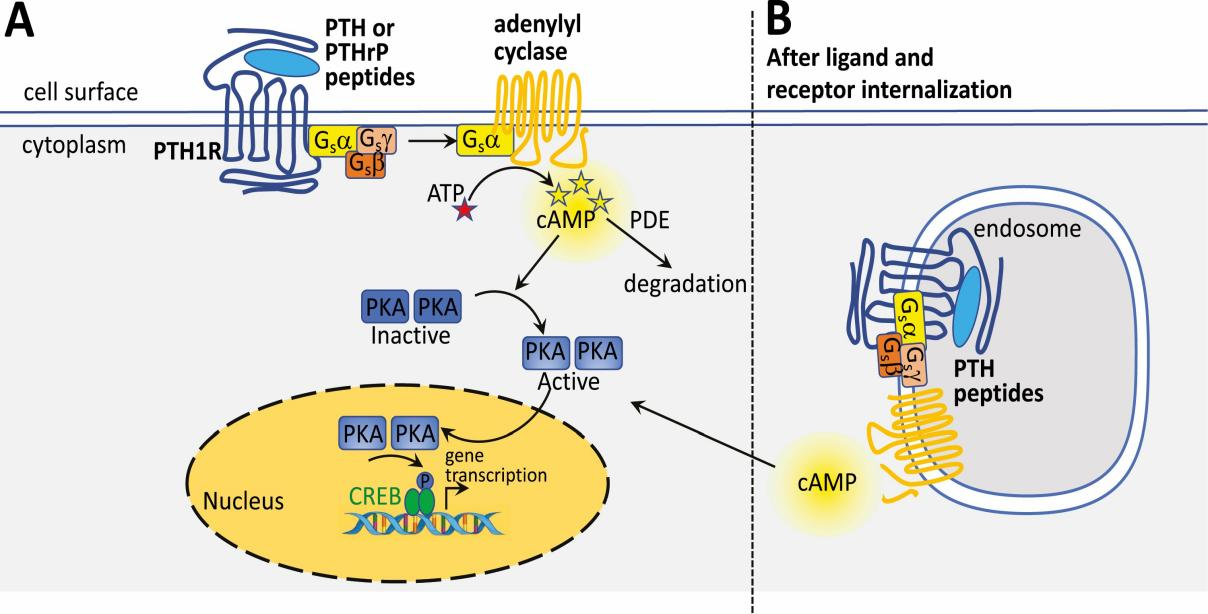
阿片受體在這些部位的激活位置直接抑制神經(jīng)元,進(jìn)而抑制脊髓疼痛的傳遞。這些受體參與去抑制的過程傳導(dǎo)至神經(jīng)元將有害刺激轉(zhuǎn)化為動(dòng)作電位并傳導(dǎo)到脊髓。從傷害感受器傳遞信息到上升的脊髓神經(jīng)元,然后再到大腦通過單突觸接觸和/或通過中間神經(jīng)元進(jìn)行調(diào)節(jié)。被激動(dòng)劑激活后,如內(nèi)源性μ-阿片肽(Endorphin),或外源性激動(dòng)劑如嗎啡(Morphine)和芬太尼(Fentanyl)的Gα和Gβγ亞基彼此分離并隨后作用于各種細(xì)胞內(nèi)效應(yīng)物通路。
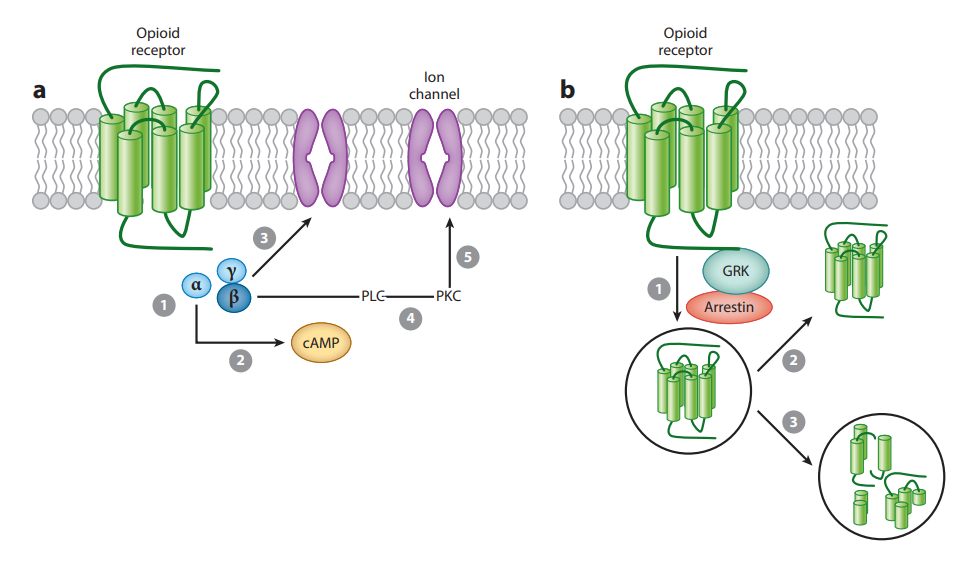
早期阿片受體藥理學(xué)研究表明,鳥嘌呤三磷酸鳥苷(GTP)等核苷酸調(diào)節(jié)激動(dòng)劑與腦組織膜制劑中的阿片受體結(jié)合。后來確定GTPase活性由阿片激動(dòng)劑和內(nèi)源性阿片肽調(diào)節(jié)。激動(dòng)劑刺激阿片受體抑制環(huán)腺苷一磷酸(AMP)的產(chǎn)生方式與其他類型的g蛋白偶聯(lián)受體(GPCR)相似。阿片受體對(duì)cAMP信號(hào)的抑制通路屬于Gαi依賴,即阿片受體和激動(dòng)劑結(jié)合時(shí)會(huì)抑制cAMP的形成。四個(gè)阿片受體具有相似的信號(hào)通路,每個(gè)阿片受體上的選擇性配體結(jié)合阿片受體后可引起cAMP形成抑制,MAPK信號(hào)通路激活,或者Arrestin招募,蛋白內(nèi)化等。
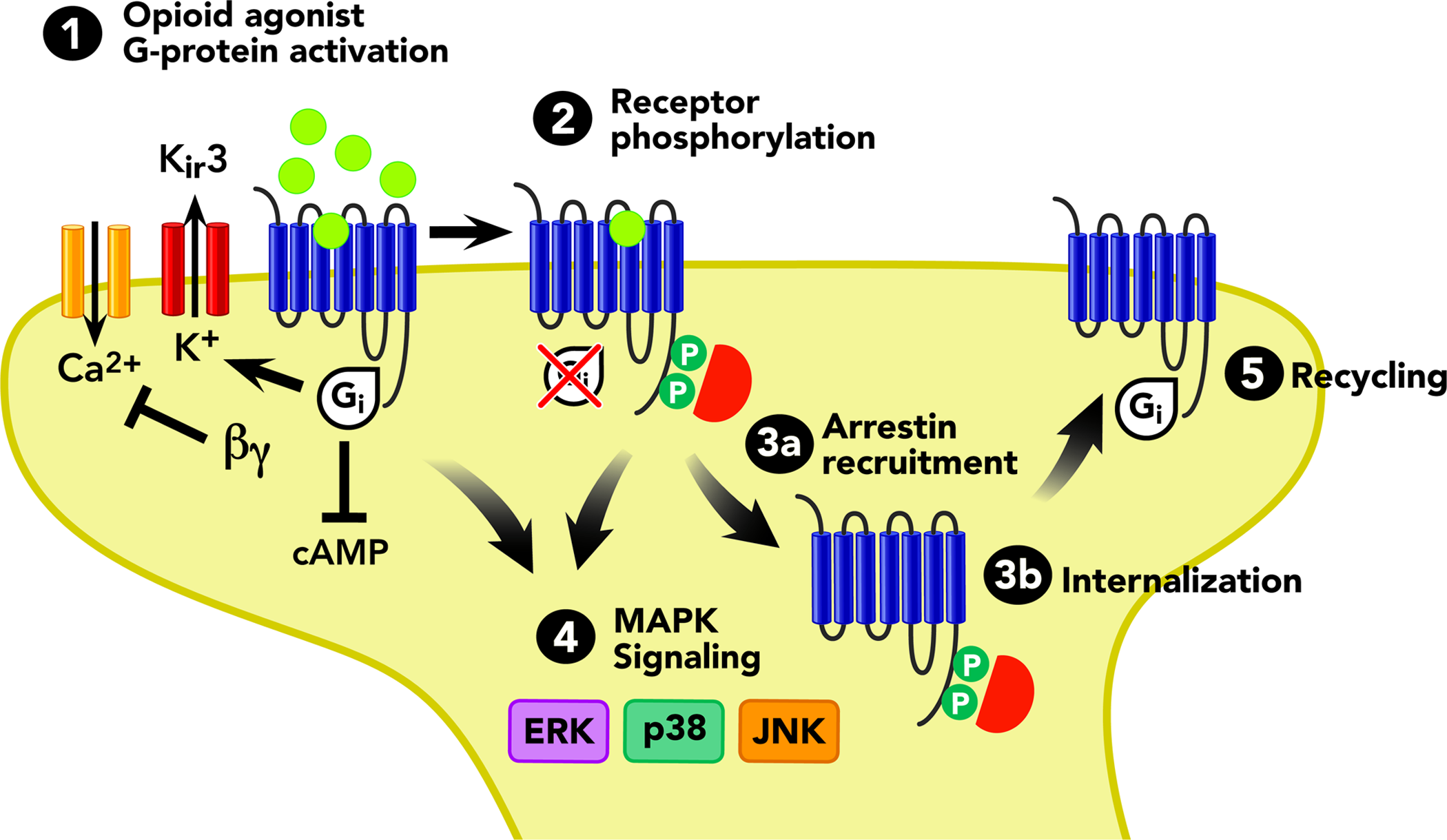
OPR細(xì)胞篩選模型
針對(duì)OPR及相關(guān)信號(hào)通路藥物的檢測,科佰生物及時(shí)開發(fā)了OPRM1,OPRD1,OPRK1,及OPRL1等細(xì)胞模型,助力OPR藥物的研發(fā)。

部分功能驗(yàn)證數(shù)據(jù)如下:
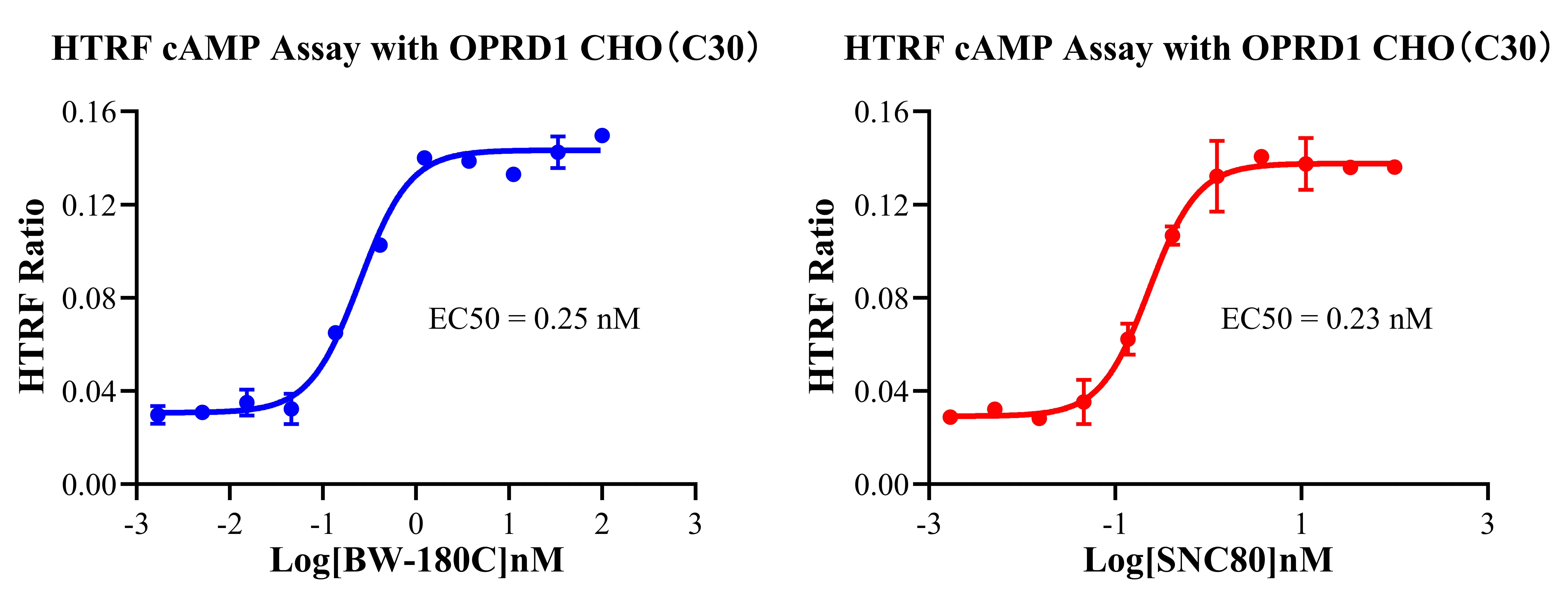
Figure 5. HTRF cAMP Assay with OPRD1 CHO(C30).
OPRD1 β-Arrestin CHO CBP71464
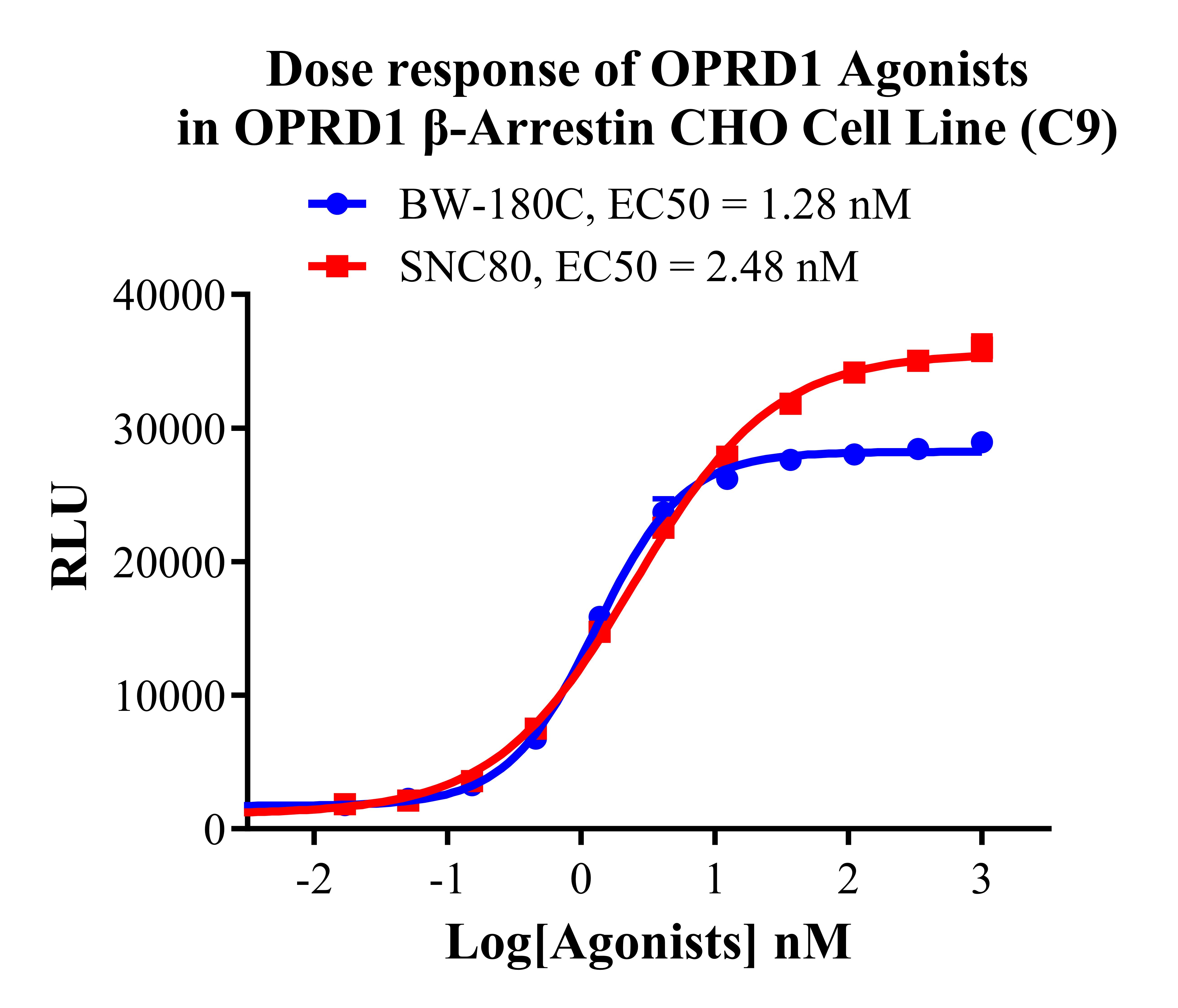
Figure 6. Dose response of OPRD1 Agonists in OPRD1 β-Arrestin CHO Cell Line (C9).
OPRM1 CHO CBP71463
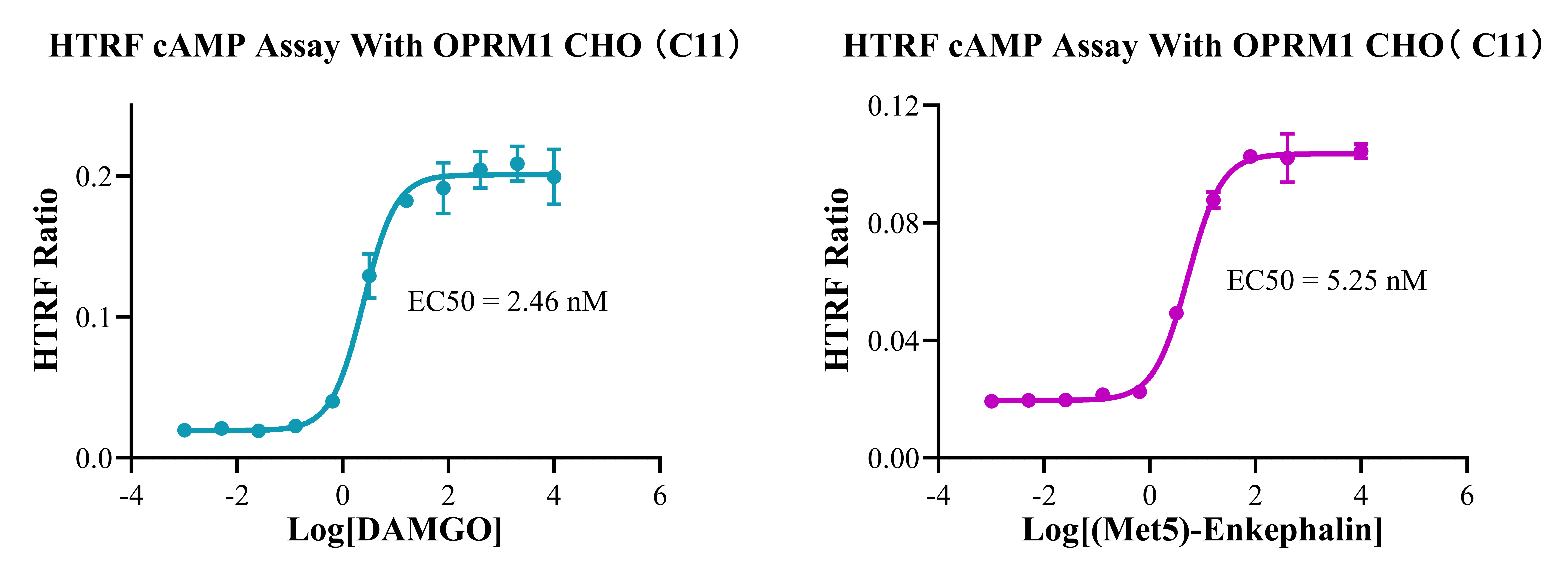
Figure 7. HTRF cAMP Assay with OPRM1 CHO(C11).
OPRM1 β-Arrestin CHO CBP71469
Figure 8. Dose response of OPRM1 Agonists in OPRM1 β-Arrestin CHO(C8).
OPRK1 CHO CBP71472
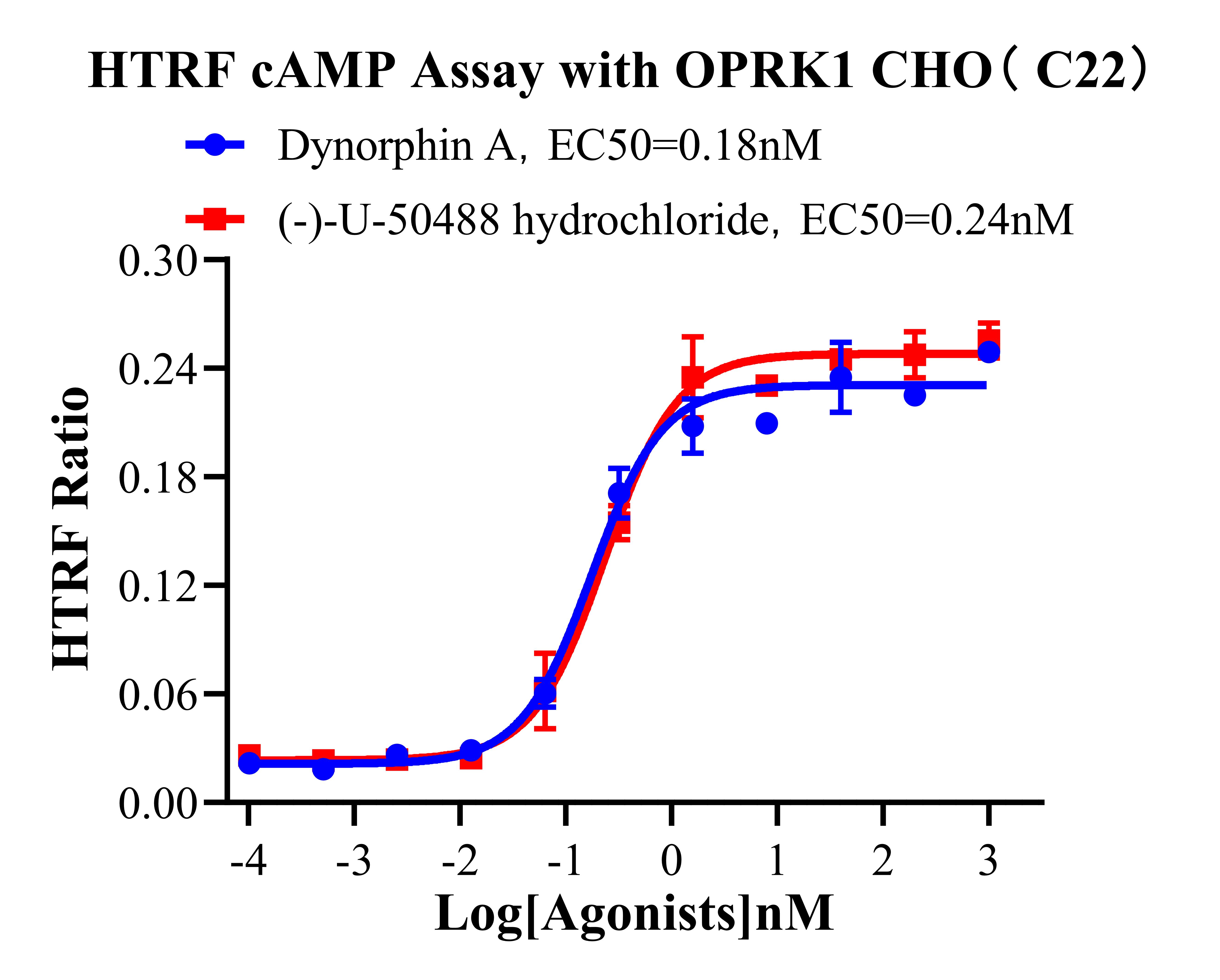
Figure 9. HTRF cAMP Assay with OPRK1 CHO.
OPRK1 β-Arrestin CHO CBP71471
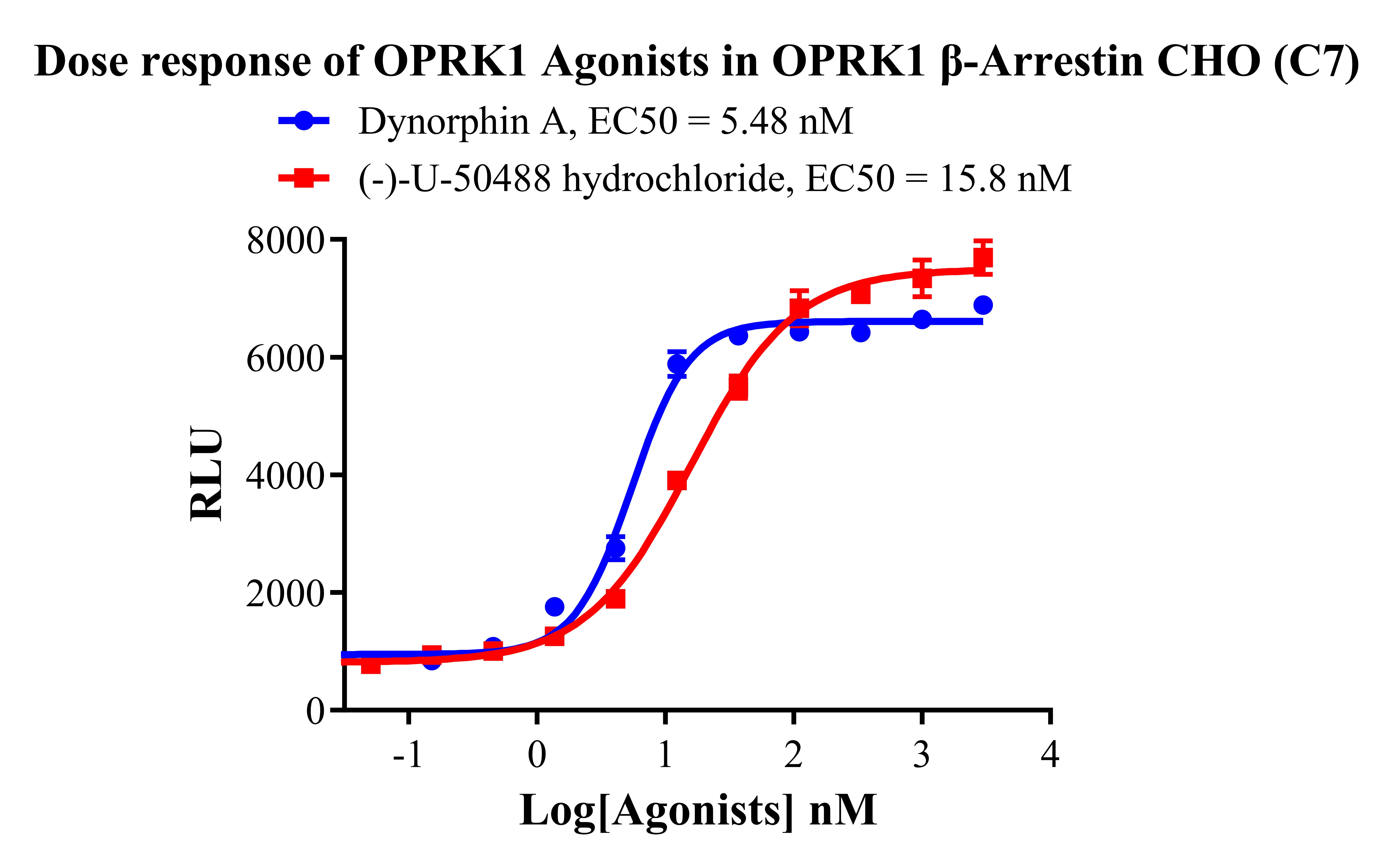
Figure 10. Dose response of OPRK1 Agonists in OPRK1 β-Arrestin CHO(C7).
OPRL1 CHO CBP71462
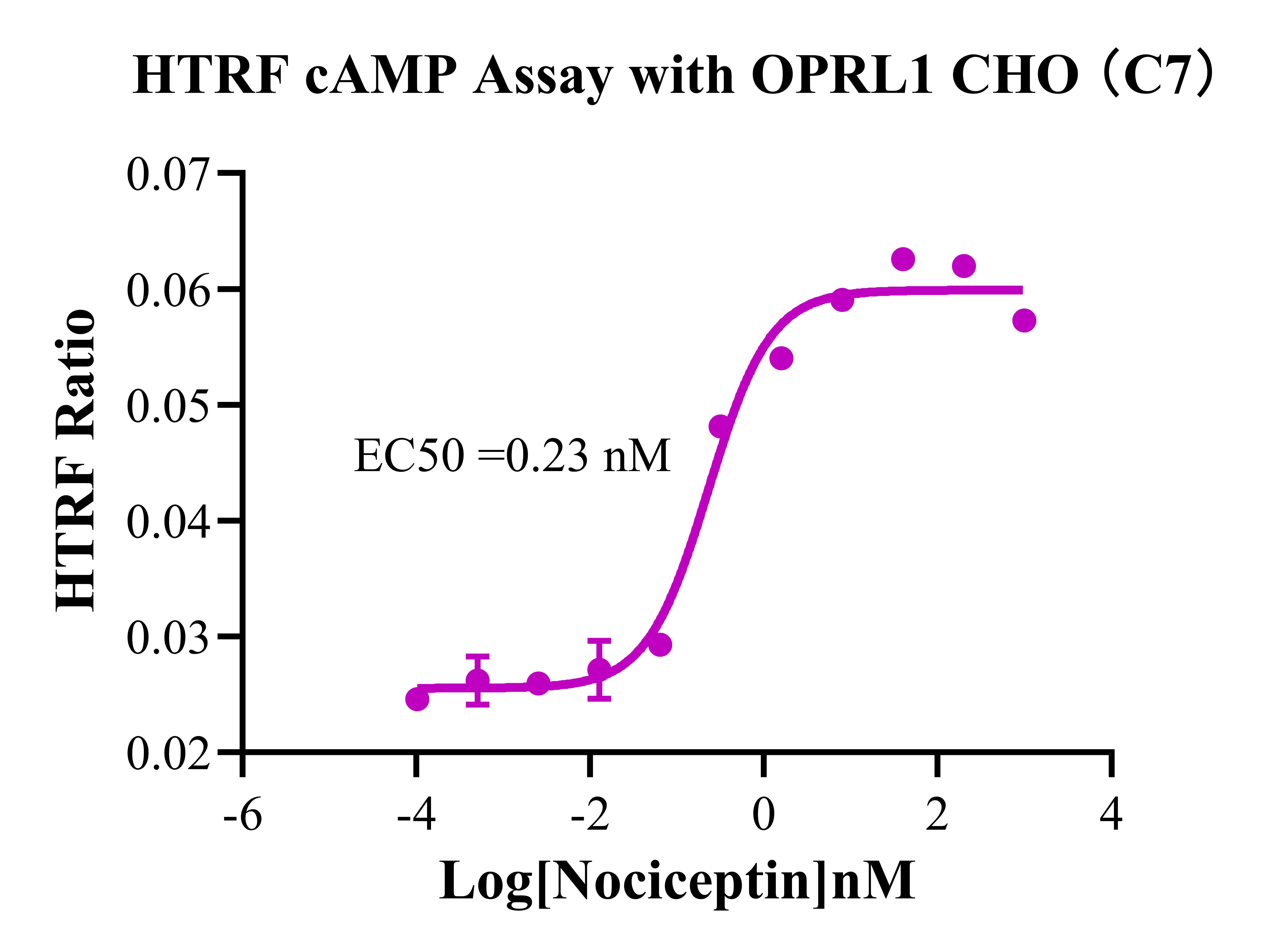
Figure 11. HTRF cAMP Assay with OPRL1 CHO(C7).
OPRL1 β-Arrestin CHO CBP71470
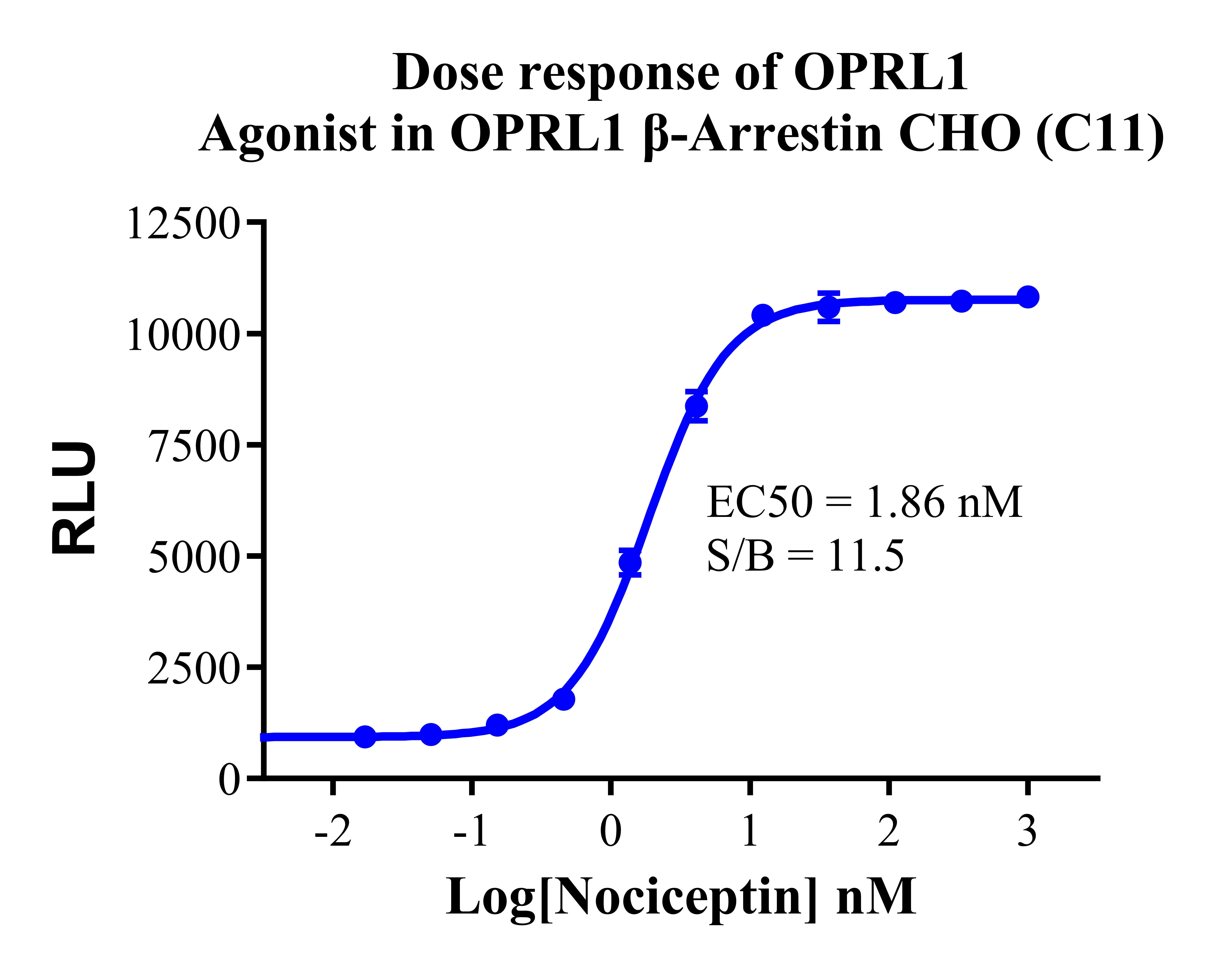
Figure 12. Dose response of OPRL1 Agonist in OPRL1 β-Arrestin CHO(C11).