PD-1/L1 &4-1BB雙靶點(diǎn)細(xì)胞篩選模型
發(fā)布時(shí)間:2022/12/30分類:技術(shù)文章來源:科佰生物
近年來,通過針對(duì)以PD-1/PD-L1通路為代表的免疫檢查點(diǎn)抑制劑調(diào)節(jié)T細(xì)胞功能的免疫療法,使癌癥治療取得了革命性的突破。但仍有相當(dāng)比例的癌癥患者對(duì)免疫檢查點(diǎn)抑制劑沒有響應(yīng),而許多最初獲得響應(yīng)的患者最終也會(huì)因?yàn)楦鞣N機(jī)制對(duì)免疫檢查點(diǎn)抑制劑產(chǎn)生耐藥,這些現(xiàn)狀突顯了開發(fā)具有更好更廣泛療效的新型免疫檢查點(diǎn)治療策略的需求。盡管免疫檢查點(diǎn)抑制劑治療在理論上可以增強(qiáng)T細(xì)胞反應(yīng),但由此引發(fā)的抗腫瘤的效應(yīng)并不總是發(fā)生或足夠,而靶向共刺激受體(如4-1BB、GITR和OX-40等)似乎是克服現(xiàn)有免疫療法無響應(yīng)并進(jìn)一步增強(qiáng)耗盡的腫瘤特異性T細(xì)胞功能,從而引發(fā)顯著的抗腫瘤反應(yīng)的一種有希望的治療策略。
研發(fā)現(xiàn)狀
目前,基于上述策略開發(fā)的一些靶向共刺激受體的藥物正處于臨床研究階段,其中,受體4-1BB(CD137或TNFRSF9)是一個(gè)廣泛獲得關(guān)注的靶點(diǎn)。4-1BB激動(dòng)劑抗體在各種臨床前模型以及人CD8+腫瘤浸潤淋巴細(xì)胞(TIL)中顯示出強(qiáng)大的抗腫瘤效果。Urelumab是第一個(gè)被開發(fā)的4-1BB激動(dòng)劑抗體,它能誘導(dǎo)4-1BB介導(dǎo)的信號(hào)傳導(dǎo)的有效激活,但由于兩例嚴(yán)重的肝毒性導(dǎo)致患者死亡,其臨床開發(fā)一度被迫停滯。這種肝毒性可能是由肝髓細(xì)胞上4-1BB信號(hào)的激活和隨后白細(xì)胞介素27的產(chǎn)生引起的,進(jìn)一步的研究表明,Urelumab劑量是影響肝毒性發(fā)展的最關(guān)鍵因素,然而,為避免肝毒性而使用相對(duì)較低劑量的Urelumab單抗是否能引發(fā)足夠的抗腫瘤反應(yīng)也存在疑問。Utolimumab則是另一種進(jìn)入臨床的4-1BB激動(dòng)劑抗體,雖然其表現(xiàn)出輕微的肝毒性,但在一期臨床試驗(yàn)中卻顯示療效不佳。因此,開發(fā)具有最小肝毒性兼具足夠抗腫瘤效力的4-1BB激動(dòng)性抗體成為該靶點(diǎn)藥物開發(fā)的迫切需求。
在開發(fā)有效的免疫檢查點(diǎn)療法(包括免疫檢查點(diǎn)抑制劑、激動(dòng)性抗體和聯(lián)合療法等)中,一些新的技術(shù)被不斷運(yùn)用于抗體優(yōu)化,其中雙特異性抗體(BsAb)通過設(shè)計(jì)兩個(gè)抗原結(jié)合位點(diǎn)的物理連接來實(shí)現(xiàn)同時(shí)作用于兩個(gè)不同靶點(diǎn)的策略已經(jīng)被廣泛應(yīng)用。考慮到共刺激受體和配體復(fù)合物必須在結(jié)構(gòu)上聚簇以傳遞強(qiáng)的共刺激信號(hào),雙抗可用于誘導(dǎo)靶點(diǎn)(如共刺激受體)的超簇,同時(shí)又避免了FcγR介導(dǎo)的聚簇,并通過設(shè)計(jì)兩種不同分子的交聯(lián)來限制脫靶效應(yīng),其中一種分子靶向特定的位置或細(xì)胞類型,因此,與聯(lián)合治療相比,雙抗技術(shù)在針對(duì)共刺激靶點(diǎn)的激動(dòng)劑抗體開發(fā)上,在特異性和療效方面具有獨(dú)特的優(yōu)勢(shì)。
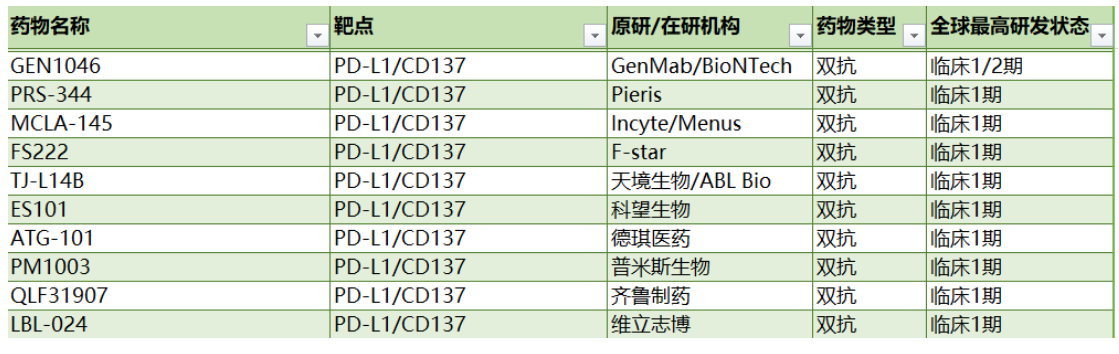
由于4-1BB在高度耗竭的PD-1高表達(dá)CD8+TIL上顯著表達(dá),并且在PD-1阻斷后進(jìn)一步上調(diào),而4-1BB信號(hào)傳導(dǎo)則會(huì)誘導(dǎo)CD8+TIL的克隆擴(kuò)增,CD8+TIL表現(xiàn)出腫瘤反應(yīng)性而無終末分化,因此4-1BB和PD-L1可能是誘導(dǎo)T細(xì)胞抗腫瘤反應(yīng)機(jī)制上的一對(duì)好搭檔。針對(duì)這兩者開發(fā)雙特異性抗體是一種極具前景的開發(fā)策略,引得國內(nèi)外玩家紛紛參與,目前已有十余款針對(duì)PD-L1/4-1BB的雙抗藥物處于不同的研發(fā)介段,下表列舉了部分已進(jìn)入臨床的雙抗藥物:
科佰生物
針對(duì)PD-1/L1&4-1BB抗體藥物尤其是雙特異抗體藥物的研發(fā),科佰生物特別開發(fā)了PD-1/L1&4-1BB雙靶點(diǎn)細(xì)胞篩選模型,可從細(xì)胞水平功能性的測(cè)活及評(píng)估PD-1/L1&4-1BB聯(lián)合用藥以及雙特性抗體的藥效,產(chǎn)品信息及相關(guān)數(shù)據(jù)如下:
PD1/41BB Dual Effector Reporter Cell CBP74172
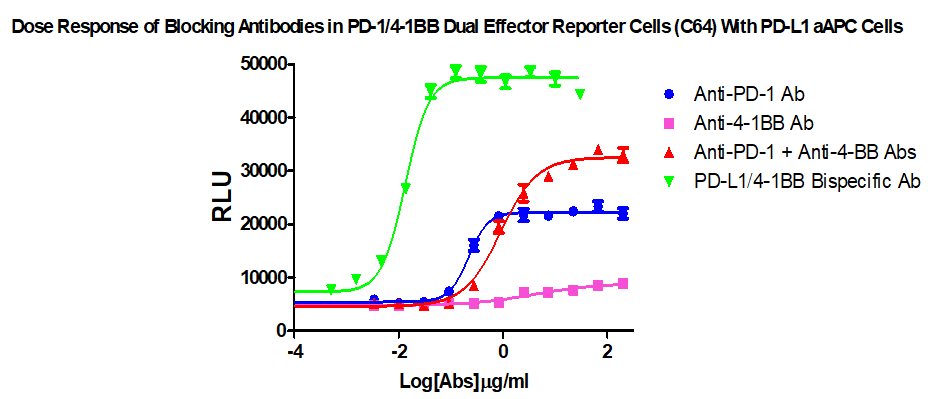
Figure 1. Dose Response of Blocking Antibodies in PD-1/41BB Dual Effector Reporter Cells (C64) With PD-L1 aAPC Cells.